Le CO2 injecté à Grandpuits sera mis en contact avec l'eau de la nappe du Dogger. Du fait de sa solubilité avec l'eau, il sera entraîné par celle-ci lors de son écoulement dans le milieu poreux que constitue le sol, puis se trouvera mélangé avec les eaux de surface pour finalement retourner dans l'atmosphère.
__________________________________
CO2 : solide, liquide, gaz, supercritique ?
Le CO2 se présente sous plusieurs états (gaz, liquide, solide, supercritique). Le schéma suivant indique cet état en fonction de la température et de la pression [1].
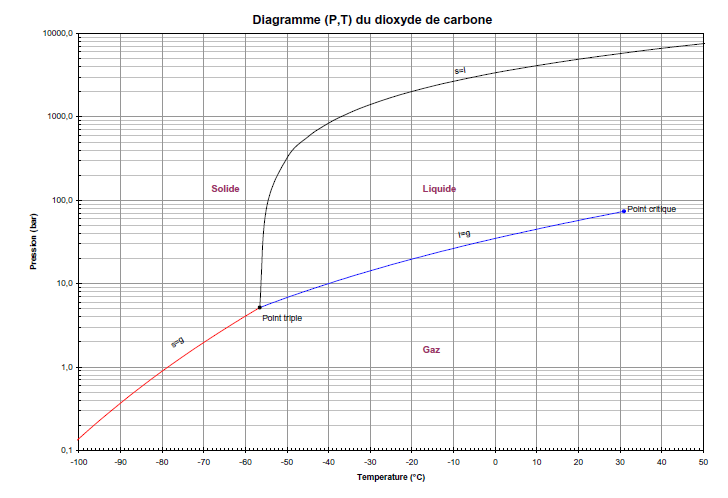
•Point triple T : Température -56,56 °C / Pression 5,1867 bar
•Point critique C : Température 31,06 °C / Pression 73,83 bar / Masse volumique 468,19 kg/m3
L'injection au niveau de Grandpuits dans la nappe du Dogger conduit à une température de l'ordre de 80°C et à une pression voisine de 180 bars. Le CO2 est alors dans un état supercritique : le point critique est largement dépassé. Sa masse volumique est inférieure à celle de l'eau : il se place localement au-dessus de la nappe d'eau saline.
masse molaire du CO2 : 44 g / masse molaire moyenne de l'air : 29 g
densité du CO2 gazeux par rapport à l'air : 1,51
Rapport CO2 gazeux à CO2 supercritique : 22,4 x 1 000 000 /(1 000 x 44)
1 tonne de CO2 supercritique = 509 m3 de CO2 gazeux conditions normales - 1 million de tonnes enfouies/an représentent plus de 500 millions de m3 de CO2 gazeux/an
__________________________________
Solubilité du CO2 dans l'eau
La solubilité désigne la concentration massique maximale en CO2 dissous.
La référence [1] présente les divers états du CO2 lorsqu'il se trouve mélangé à l'eau.
Le dioxyde de carbone est un gaz faiblement soluble dans l'eau. Il peut se trouver sous 3 formes :
- sous forme de molécules : CO2(aq)
Ce CO2 aqueux réagit alors avec l'eau pour former des hydrogénocarbonates
CO2(aq) + H2O <-> HCO3-(aq) + H+(aq) (1)
- sous forme d'ions Hydrogénocarbonate qui acidifient l'eau
Ces ions Hydrogénocarbonate se dissocient eux-mêmes avec l'eau pour former des carbonates
HCO3-(aq) + H2O <-> CO32-(aq) + H+(aq) (2)
- sous forme d'ions Carbonate qui acidifient l'eau
Ces différents ions sont présents en concentration variable en fonction du pH (acidité du milieu). Dans le cas de l'eau de mer, la répartition est la suivante [1] :
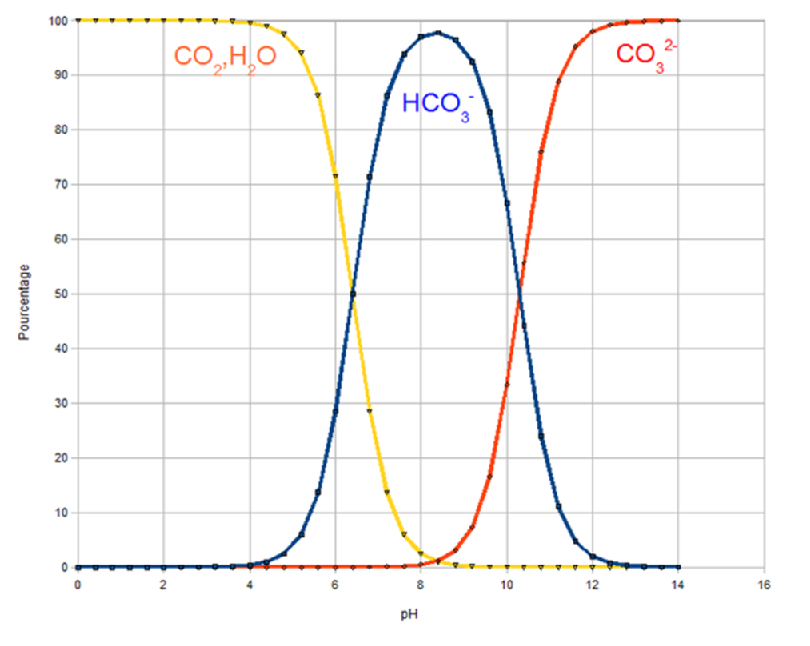
La solubilité d'un gaz dans un liquide diminue avec la température et s'accroit avec la pression. Ceci se traduit par la loi de Henry ainsi : la fraction molaire du CO2 dans l'eau est proportionnelle à la pression partielle de CO2
C = H.P où H désigne le coefficient de Henry - coefficient fonction de la température
A la pression atmosphérique, la solubilité s'établit selon :
| température (°C) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
|---|---|---|---|---|---|---|---|
| solubilité (g/L) | 3,346 | 2,318 | 1,688 | 1,257 | 0,973 | 0,761 | 0,576 |
Ces considérations sur la solubilité du CO2 dans l'eau sont fondamentales. Elles interviennent à deux niveaux :
elles définissent les conditions des équilibres chimiques de l'absorption du CO2 dans l'eau du Dogger d'une part, et de la désorption du CO2 dans l'air lorsque la nappe du Dogger repasse au contact de l'air d'autre part.
l'eau constituant le solvant du sang, elles expliquent l'acidification du sang au contact d'un surcroit de concentration de CO2 dans les poumons et par conséquent sa toxicité.
__________________________________
autres réactions chimiques
Les réactions chimiques du CO2 avec la matière ne se limitent pas à la solubilité dans l'eau. Nous n'abordons pas ici, par exemple, les réactions avec les divers minéraux rencontrés lors de la migration de la nappe acidifiée du Dogger jusqu'à la surface du sol. Pour se faire, il serait déjà nécessaire de connaître ces minéraux, ainsi que les conditions pression/température où ils se trouvent.
Les polluants du CO2 non éliminés totalement lors de traitements préalables avant injection contriburaient aussi à la pollution de la nappe du Dogger.
____________________________
Retour page d'accueil


